Физическая реабилитация больных инфарктом Миокарда
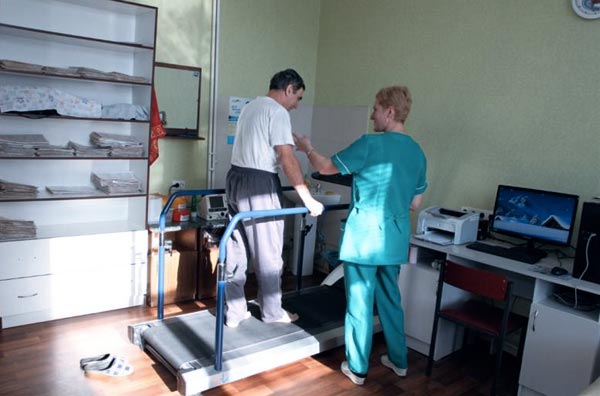
Реабилитация, или восстановительное лечение,— комплекс мероприятий, направленных на возврат больного к общественно-полезной деятельности и снижению инвалидизации. В этом аспекте большое значение имеет повышение переносимости физических нагрузок, т. е. та часть указанных направлений, которая относится к физической реабилитации.
Основная тенденция в проведении восстановительного лечения у больных инфарктом миокарда за последние десять лет — ускорение темпа активизации больных, сокращение периода иммобилизации. Развитие этого направления обосновано тем, что длительная гипокинезия оказывает неблагоприятное влияние на сердечно-сосудистую систему и приводит к более тяжелым ортостатическим реакциям при активизации больного. Известно также, что в положении лежа увеличивается нагрузка на сердце, так как оно должно осуществлять больший выброс (ударный и минутный объемы в положении больного лежа больше, чем стоя).
Проведение ускоренных программ активизации показало целесообразность развития этого направления, которое разрабатывается многими кардиологами (Е. И. Чазов, 1970, 1975; И. К. Шхвацабая, 1972, 1974; Д. М. Аронов, 1972, 1977; 3. И. Янушкевичус и И. Б. Мисюнене, 1975; И. Е. Ганелина, 1977; N. В. Askanas, 1972, и др.).
Согласно материалам ВОЗ (1969), активизация в стационаре может проводиться по двум схемам: 3—4-недельная и 5—6-недельная.
По первой из них больной самостоятельно принимает пищу с первых дней и пользуется с посторонней помощью переносным туалетом. ЛФК начинается с 1—2-го дня. С середины недели больной сидит в постели, первоначально в течение 5 мин. К началу 2-й недели больной встает, с середины 2-й недели разрешен выход в туалет. На 3-й неделе больной ходит по коридору, с середины недели начинает осваивать подъем по лестнице и к концу недели поднимается на лестничный пролет. В конце 4й недели осваивается дистанционная ходьба на расстояние 500 м и разрешается прогулка при отсутствии ветренной, дождливой погоды и при температуре не ниже 5° С. Скорость подъема по лестнице составляет 15 ступенек в 1 мин, ходьбы по ровной местности — 1 км/ч. Эта программа может быть использована при ограниченных инфарктах миокарда с неосложненным течением. В последние годы она находит все больше последователей.
Реабилитация по второй схеме начинается с ЛФК во второй половине 1-й недели. К концу 2-й — началу 3-й недели больной сидит, на 4-й неделе — стоит и к концу недели проходит расстояние 200—250 м за 15 мин, на 5-6-й неделе осваиваются подъем на второй этаж и ходьба на расстояние 500 м при скорости 2 км/ч.
Выбор той или иной программы определяется характером течения заболевания. Активную реабилитацию нельзя проводить при состояниях кардиогенного шока, наличии острой сердечной недостаточности, опасных нарушениях ритма (тахикардия, полная аv-блокада, множественные или политопные экстрасистолии, а также «ранние» экстрасистолы «R» на «Т»), упорной стенокардии, лихорадке.
При подозрении на развитие острой аневризмы сердца у больных трансмуральным инфарктом миокарда двигательный режим расширяется в более медленном темпе. ЛФК назначается на 2-й неделе заболевания. Активный переход в положение сидя осуществляется на 3-й неделе, в положение стоя — на 4-й неделе, на 6-й неделе осваивается ходьба на расстояние 200 м, в конце 7-й недели — подъем на лестничный пролет при темпе 15 ступенек в 1 мин. В течение 8-й недели больной овладевает дистанционной ходьбой на расстояние 500 м при скорости 2 км/ч.
Расширение двигательного режима происходит на фоне постепенного усложнения комплекса ЛФК: комплекс № 1 готовит больного к переводу в положение сидя, №2 — в положение стоя, №3 — назначается с целью освоения ходьбы. Соответственно с усилением комплекса ЛФК увеличивается расход энергии (в ккал/мин) на комплекс гимнастики: от 1,50 при комплексе № 1 до 1,6 при комплексе № 2 и 1,85 при комплексе № 3.
Стремление к возможно ускоренной активизации больного должно сочетаться с оценкой индивидуальных физических его возможностей. Поэтому чрезвычайно большое значение приобретают методы контроля за адекватностью выполненной больным физической нагрузки. Усложнение ее недопустимо при ускорении пульса более чем на 30 ударов в 1 мин и замедлении его более чем на 10 ударов в 1 мин, а также если появляются или усиливаются признаки сердечной недостаточности, возникают опасные нарушения ритма, наблюдаются усиление болевого синдрома, появление коллаптоидного состояния, значительное повышение артериального давления. Переход к последующему этапу двигательной активности может быть рекомендован с учетом данных ЭКГ-контроля.
Электрокардиограмма регистрируется до нагрузки, во время проведения и после ее окончания. До нагрузки записываются 12 отведений ЭКГ. Во время нагрузки желательна запись R-ЭКГ (в отведении С4 — С5 или ведущем отведении). После нагрузки регистрируются 12 отведений сразу после ее окончания, затем несколько раз в течение 6—10 мин. У 98% больных коронарной недостаточностью возникшие изменения на ЭКГ сохраняются в течение 1-й минуты после нагрузки.
Показателями того, что нагрузка является неадекватной для больного, служат:
1) смещение сегмента ST ниже изоэлектрической линии на 0,1 мВ и более или восходящее смещение;
2) продолжительность смещения сегмента ST превышает 0,08 с;
3) отношение (Q — x)/(Q — T) больше 50%. Точка х определяется на ЭКГ при пересечении смещенного сегмента ST с базальной линией;
4) увеличение интервала QT на 7% и более по сравнению с должной величиной;
5) дискордантное смещение сегмента ST в различных отведениях;
6) увеличение зубца Т в 3 раза по сравнению с исходной величиной в грудных отведениях;
7) снижение зубца Т на 25% и более по сравнению с исходной величиной, инверсия зубца Т;
8) извращение зубца U;
9) снижение зубца R на 50% по сравнению с состоянием покоя;
10) многочисленные экстрасистолы, замедление внутрижелудочковой проводимости.
Следует указать, что изменение зубца Т — наиболее дискуссионный признак. Так, при непрерывной записи ЭКГ в течение 20 ч установлены колебания амплитуды зубца Т у 30% здоровых лиц. Чаще всего они выражаются в двухкратном увеличении зубца. Поэтому ряд исследователей предлагают учитывать изменение этого зубца только при совместном изменении сегмента ST или интервала QT, а также при длительном изменении зубца в случаях, если инвертированный зубец превышает 2 мм. При оценке ЭКГ у лиц, перенесших инфаркт миокарда, с нашей точки зрения, изменения зубца Т должны быть учтены, так как в этих случаях трудно доказать физиологичность наблюдаемых сдвигов. Спорным признаком неадекватности нагрузки является позитивизация зубца Т, однако появление ее вместе со смещением сегмента ST вверх по типу «омоложения» ЭКГ является беспорным критерием. Этот признак наиболее характерен для реакции больных на нагрузку при наличии аневризмы сердца. Степень депрессии сегмента ST также обсуждается. Наряду с указанием ВОЗ (1969, 1974) в том, что принимается во внимание смещение сегмента ST на 2 мм и более, некоторые авторы учитывают глубину смещения и на 1 мм. Нужно помнить, что существует зависимость между степенью депрессии при нагрузке и смертностью от ишемической болезни: при смещении сегмента ST на 1 мм она возрастает в два раза по сравнению с вероятной для данной возрастной группы, а при смещении более 2 мм — в 20 раз. При переходе больного в положение сидя или стоя не могут приниматься во внимание сдвиги ЭКГ, связанные с изменением направления электрической оси сердца, а также колебания амплитуды зубцов R и Т, зависящие от положения тела. Иногда сдвиги ЭКГ возникают после окончания физической нагрузки.
По нашим наблюдениям, изменения ЭКГ являются наиболее частыми проявлениями неадекватности выполняемой нагрузки. Индивидуальный контроль за адекватностью каждого этапа двигательного режима с применением ЭКГ позволил путем индивидуализации расширения двигательной активности снизить частоту неадекватных ответов на физическую нагрузку до 5—10%.
При значительном усилении болевого синдрома, появлении признаков неадекватности кровообращения, развитии опасных нарушений ритма сердечной деятельности, тахикардии, ритма галопа режим должен быть ограничен и проведена соответствующая фармакологическая коррекция. После ликвидации осложнений снова может быть восстановлен прежний режим двигательной активности. При изменении только электрокардиограммы, свидетельствующем об усилении гипоксии миокарда во время нагрузки, рекомендуется задержка на 2—3 дня на предыдущем уровне двигательного режима и затем повторное исследование.
При сохранении неадекватной реакции необходимо усилить медикаментозную терапию, направленную на повышение толерантности к физической нагрузке. Для этой цели могут быть использованы нитраты, β-адреноблокаторы, сердечные гликозиды. Последние, как показали наши исследования (М. Г. Ильяш, 1977), снижают потребление кислорода после окончания работы (в период восстановления), несколько увеличивают потребление кислорода в период нагрузки. Таким образом, применение сердечных гликозидов оправдано с точки зрения наиболее экономного энергетического обмена и нагрузке. При отсутствии клинических признаков недостаточности кровообращения II степени сердечные гликозиды целесообразнее применять у лиц с обширным инфарктом миокарда, осложненным аневризмой сердца, так как у таких больных при выполнении стандартной физической нагрузки отмечается большая величина кислородного долга, чем при меньшем поражении миокарда (М. Г. Ильяш, 1977).
Сердечные гликозиды снижают достоверность ЭКГ-контроля за адекватностью нагрузки, так как усугубляют депрессию сегмента ST не только в состоянии покоя, но и при нагрузке. В таких случаях для контроля за адекватностью выполненного этапа двигательного режима можно использовать величины расхода энергии и кислородного пульса. Так, при адекватном выполнении ходьбы на дистанцию 200 м расход энергии на 1-й минуте отдыха составляет 2,1 ±0,24 ккал/мин, а кислородный пульс — 5,7 ± 0,59 мл/мин. При неадекватном ответе эти величины больше: соответственно 2,3 ± 0,14 ккал/мин и 6,0 ± 0,30 мл/мин (Н. Ю. Купина, 1975).
Механизм действия нитратов с точки зрения повышения толерантности к физической нагрузке весьма сложен. Существенное значение, очевидно, имеет снижение работы сердца, β-адреноблокаторы способны повышать переносимость нагрузки не только за счет анальгезирующего влияния и отрицательного хронотропного эффекта, но и за счет увеличения содержания внутриклеточного калия и снижения потребности миокарда в кислороде, т. е. снижения работы сердца. Имеются данные (Г. В. Яновский с соавт., 1976) об увеличении под влиянием анаприлина (обзидана) кислородного пульса во время выполнения нагрузки, несмотря на отсутствие повышения сердечного выброса.
После окончания программы реабилитации в стационаре больной может быть направлен в реабилитационный центр местной климатической зоны или остаться под амбулаторным наблюдением. Реабилитационный центр должен быть обеспечен не только врачами — кардиологами и специалистами по кинезитерапии, но и электрокардиографическим (в том числе и R-ЭКГ) контролем. При необходимости должна быть оказана ургентная помощь. Санаторный этап лечения рекомендуется больным, у которых отсутствуют гипертоническая болезнь III стадии, «опасные» аритмии, недостаточность кровообращения II, III степени, легочно-сердечная недостаточность, недостаточность почек, печени, тромбоэмболические осложнения, частые приступы стенокардии. В санатории направляются только лица, способные к самообслуживанию.
Ведение периода выздоровления считается удовлетворительным, если через 2,5—3 мес от начала развития инфаркта миокарда больной делает прогулки на расстояние 1—4 км в день, через 3,5—4 мес — 3—6 км (в два приема). При этом увеличиваются (в случае оптимального ведения реабилитации) скорость ходьбы (от 2 до 3—4 км/ч), число ступенек при подъеме на лестницу (добавляется один-два лестничных пролета в неделю) и скорость подъема. Так, через 4 мес от начала заболевания скорость ходьбы по лестнице составляет 30 ступенек в 1 мин при общем количестве ступенек 120.
Расширение двигательного режима начинается со 2-й недели после выписки из стационара. На 2-й неделе увеличивается скорость ходьбы. Дистанционная ходьба достигает к концу 4-й недели после выписки из стационара 2000 м за один прием, в вечернее время сохраняется половинный объем нагрузки. На 5—6-й неделе дистанционная ходьба утром увеличивается на 500 м в неделю, вечером сохраняется меньший объем. Скорость ходьбы можно увеличить до 4 км/ч.
Подъем по лестнице можно увеличить уже в 1-ю неделю после выписки из стационара, через 3—4 дня повышается также скорость подъема до 20 ступенек в 1 мин, а на 5—6-й неделе — до 30 ступенек в 1 мин. Вечером сохраняется половина утренней нагрузки. При наличии аневризмы сердца в течение 2 нед после выписки из стационара дистанционная ходьба не превышает 1000 м, темп ходьбы не ускоряется. Во второй половине дня повторяется половина дистанционной ходьбы. В последующем она увеличивается утром на 500 м каждые 1—2 нед, вечером сохраняется половина дистанции. Скорость ходьбы на 6-й неделе достигает 3 км/ч.
С 3—4-го дня пребывания вне стационара увеличивается число подъемов на 2 лестничные ступеньки в день: при освоении 60 ступенек темп ускоряется до 20 ступенек в 1 мин, а с 8-й недели после выписки — до 30 ступенек в 1 мин. Комплекс ЛФК усложняется до № 4. При этом у лиц с аневризмой сердца применение его требует индивидуального контроля. В период выздоровления, кроме наблюдения за состоянием кровообращения (по клиническим данным) и степенью болевого синдрома, учитываются колебания частоты пульса, артериального давления и изменения ЭКГ.
В течение 1-го месяца периода выздоровления во время упражнений пульс не должен ускоряться более чем на 20 ударов в 1 мин; у лиц пожилого возраста или принимающих сердечные гликозиды он не должен превышать 100—110 ударов в 1 мин. В дальнейшем частота пульса при выполнении нагрузки продолжительностью 30 мин может определяться по формуле: частота пульса при нагрузке равна частоте пульса в покое плюс 60% разницы между максимально допустимой частотой пульса и частотой пульса в покое.
Например, пульс в состоянии покоя равен 70 ударам в 1 мин, максимально допустимая частота пульса — 170 ударам в 1 мин, 60% разница между этими величинами составляет 60 ударов. Допустимая частота пульса при нагрузке равна 130 ударам (70 + 60). У больных, перенесших инфаркт миокарда, редко отмечается при нагрузке такая тахикардия, так как у них раньше возникает болевой синдром или ишемические изменения ЭКГ. Оценка последних аналогична приведенным в период пребывания больного в стационаре.
Систолическое артериальное давление не должно повышаться при выполнении упражнений более чем на 50 мм рт. ст. и снижаться более чем на 10 мм рт. ст.
При неудовлетворительной переносимости физической нагрузки могут быть использованы те же методы коррекции медикаментозными средствами, что и в период прерывания больного в стационаре. Наш опыт показывает, что длительный прием дипиридамола (курантила) или интенкордина (в течение нескольких месяцев) также оказывает положительное влияние.
Таким образом, наряду с основным направлением восстановительного лечения — наиболее быстрой активизацией больных — обязательно следует учитывать индивидуальную переносимость физической нагрузки и особенности клинического течения заболевания. Поэтому любая предложенная схема активизации пригодна лишь для определенного контингента больных и трансформируется с учетом конкретных условий.
После выписки из стационара больные должны быть осмотрены в диспансерных условиях через 1 мес и обязательно к концу срока пребывания на листке временной нетрудоспособности (конец 3—4-го месяца) для решения вопроса о возможности возврата к трудовой деятельности. Оценивая результаты реабилитации больных инфарктом миокарда, можно сказать, что у нас в стране и значительной степени повысилась физическая работоспособность больных инфарктом миокарда к концу срока временной нетрудоспособности. Этим созданы реальные предпосылки (И. К. Шхвацабая и Д. М. Аронов, 1974; 3. И. Янушкевичус и Н. Б. Мисюнене, 1975) для существенного снижения инвалидизации. В настоящее время 70—90% лиц с крупноочаговым инфарктом миокарда, прошедших восстановительное лечение, приступают к работе к концу 4-го месяца болезни. По нашим данным, возврат к труду лиц с аневризмой сердца к концу 6-го месяца заболевания увеличился за последние 8 лет в 4,5 раза и составляет 60,1% по сравнению с 14,5%, по данным 1969 г.
Менее отчетливые данные получены по снижению летальности после окончания острого периода заболевания и частоте повторных инфарктов. Наибольшая опасность развития повторного инфаркта миокарда и летальность отмечаются в первые 2 года болезни, поэтому в течение этого времени больные должны расширять физическую активность под тщательным контролем в диспансерных условиях.
По нашим данным, летальность в течение 1-го года составляет 8—10%, частота повторных инфарктов — 8—11—12%. Увеличилась продолжительность жизни таких больных. Если по статистике 30-х годов 75% больных умирали в течение 1-го года после перенесенного инфаркта миокарда, то в настоящее время 60—66% таких больных живут более 5 лет. В дальнейшем требует своего изучения вопрос о возможности сокращения срока временной потери нетрудоспособности. В этом направлении может представить определенные перспективы развитие санаторного этапа реабилитации, который несколько увеличит время пребывания больного в медицинском учреждении, но обеспечит большую эффективность восстановительного лечения в период выздоровления.




Добавить комментарий